談伽馬刀放射手術在腦腫瘤治療的運用及進展
本文出自癌症新探103期
高雄榮總 神經外科 劉斯顥/周及人主治醫師
2023 元月 17
腦部是人體極為重要的器官,有著既精密又脆弱的特性,這也讓腦部腫瘤的治療比身體的其他部位困難許多。無論是再怎麼樣精密的顯微手術,都是要戰戰兢兢,深怕一個不小心,就誤傷了腫瘤以外的地方。若是想要治療腦部深部的腫瘤,更是不得其門而入,恐怕還得破壞表層的腦部結構才能到達腫瘤,因而損傷了腦部重要的功能。長久以來,治療腦部內部的腫瘤一直是醫學上最具困難性的課題。幸好因醫學的進步,有更多醫療科技的發展,立體定位放射手術因應而生。利用放射線能穿透人體的特性,能達到隔山打牛的效果,不用見血也不必開腦,讓病患在開顱手術之外,能夠有低侵入性與低風險的治療選擇。
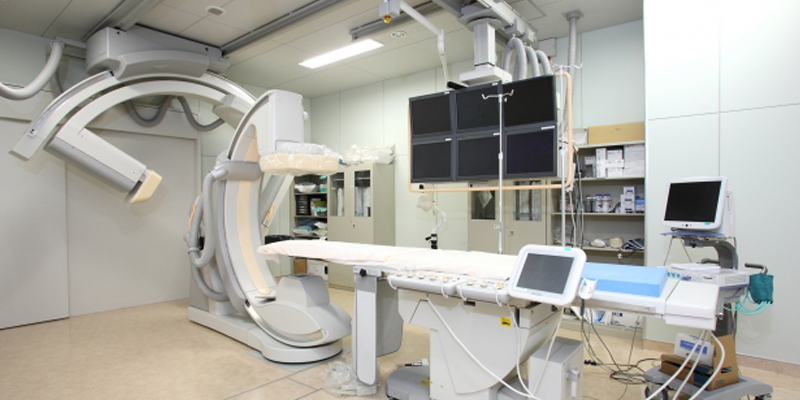
伽馬刀放射手術的歷史與發展
放射手術的概念最早於1951年由瑞典的神經外科醫師Lars Leksell所提出。他希望設計一種新的裝置,將用於治療的能量聚焦於一點來精確的治療腫瘤。在當時的時空背景之下,他尋找了各種能量來源,包含各種光子射源、x-光儀器、直線加速器,甚至超音波等。最後他選擇以鈷-60作為放射線的射源,將約兩百個射束排成一個半圓形的陣列,將放射線的能量聚焦在一點上。有別於傳統分次的放射治療,以這種概念設計單點聚焦的放射治療,因為每個射束的能量都很低,位於焦點處的能量卻極高,所以能將鄰近腦組織的傷害降到最低,因而能提高單次治療的放射劑量而達到更好的效果,這樣的治療能達到有如手術刀般精準的效果,故命名為伽馬刀。在各方專業領域的合作之下,第一台伽馬刀於1967年完成,設置於瑞典斯德哥爾摩的卡洛林斯卡學院。有著精確又低侵入性的治療特性,使得這項治療利器很快就推廣到全世界,目前全世界已經有超過500台以上的伽馬刀完成設置,接受伽馬刀放射手術的人數也已經累積超過一百萬人。時至今日,伽馬刀已經演進到了第五代機型ICON©,不僅照射過程全部電腦自動化,還搭配術中即時影像定位,提供了以頭架或面罩治療的選擇,擁有了分次治療的可能性,讓醫師在治療病患時可以有更多的彈性。
伽馬刀放射手術用於腦瘤治療
伽馬刀放射手術的發展,對於神經外科的治療也帶來了不少革新與改變,以往需要開顱手術切除的腫瘤或病灶,現在有了侵入性更少的方式可以獲得控制。特別是對於體積小、位置深的腫瘤,更得以凸顯出伽馬刀的好處。甚至某些血管性病灶如動靜脈畸形等,或是位於靜脈竇大血管上的腫瘤,有時以開顱手術處理相當困難,不僅開刀時需要花費數小時甚至數十小時浴血奮戰,更有可能在術後產生急性出血或梗塞等嚴重併發症。面對這些不易手術治療的腫瘤,使用伽馬刀放射手術治療,也可產生良好的效果。
醫療科技的進步,使得直線加速器的體積得以大幅縮小,利用放射線聚焦治療原理也衍生了很多不同的治療工具,包括電腦刀、螺旋刀、諾利刀等機型,也如雨後春筍般蓬勃發展。然而在腦瘤治療上,伽馬刀還是有其無法取代的地位。其中一點是融合了頭架的使用。有了頭架的固定,在治療的期間病患的頭部與機器不會因為位移而產生誤差,進而確保了放射線劑量能準確投射在病灶上,不會傷及旁邊重要的結構,故準確性仍然是目前所有機型裡最高的。 再來是伽馬刀的設計是採用多達192個方向的射束同時照射,以這麼多的角度同時照射,讓每個角度的劑量得以減到最低,對正常組織的影響降到最小,因此可以一次投射足夠的劑量,達到真正的單次放射手術治療,讓整個療程只需一天就結束。這些治療的特性,讓伽馬刀在腦瘤的治療上仍有無法取代的地位。
對於腦部病灶的治療範圍很廣,常見的腫瘤包括腦膜瘤、聽神經瘤、顱咽管瘤、腦下垂體瘤、部份神經膠質瘤,及惡性轉移性腫瘤等。其他還有血管異常病灶包括動靜脈畸形及血管瘤等。由於治療原理是利用放射線控制腫瘤生長,讓腫瘤在腦內自然凋亡,明顯的效果需要數個月至數年才會慢慢顯現,治療之後縮小的程度也因腫瘤的種類而有所不同,不能過度期待腫瘤縮小的效果。若是腫瘤過大或是已經產生腫塊效應壓迫腦部,恐怕還是得以開顱手術來移除腫瘤才能解決腦部的壓迫。
腦轉移性癌的伽伽馬刀放射手術治療
癌症是目前國人第一大死因,腦部的轉移處理起來更是棘手。由於腦部有獨特的生理結構—血腦屏障,使得各種藥物要在腦部達到治療濃度面臨很大的挑戰。傳統癌症的腦轉移要進行全腦放射治療,雖然希望控制整個腦部的轉移腫瘤生長,卻有可能在一段時間之後引起落髮、倦怠、甚至認知功能退化等副作用,讓癌症末期的生活品質顯著的降低。全腦放射的高劑量也讓放射治療只能有一次機會,若不幸有復發的轉移腫瘤無法再接受放射治療。
由於伽馬刀屬於精準放射治療,在沒有治療的區域僅有極少放射線劑量,因此對於例如影像檢查上看不到的微小多發性的腫瘤、顯影範圍不清楚的腫瘤、或是腦脊髓液中微小可能散布的腫瘤,無法有控制或是預防的效果。但隨著標靶藥物的進步,病患平均餘命顯著增加,伽馬刀在臨床的重要性又受到了重視。伽馬刀精準治療的特性,讓轉移的腫瘤可以獲得良好的局部控制,但不會損傷大部分正常的腦部功能,搭配標靶藥物來控制其他微小看不見的轉移腫瘤,使得病患在癌症末期的生活品質能顯著的提升。若是不幸在追蹤時發現有新的轉移出現,伽馬刀精準的特性,還能將新產生轉移的腫瘤再次的補救治療。已經有多篇研究發現伽馬刀及標靶治療有加成效果,搭配伽馬刀控制腦部轉移的病灶,可以減少腫瘤在顱內轉移的機率,增加標靶藥物的控制效果,而延長病人的存活時間。
雖然健保明文規定病灶要少於三處以下才得以健保給付,但在醫學發展之下,有越來越多的研究顯示即使有更多顆的病灶,在某些條件之下使用伽馬刀治療仍然有明顯的好處。日本因為伽馬刀治療相當普及,有著大量治療轉移腫瘤的經驗,多家醫學中心的聯合研究顯示,10處以下的轉移腫瘤,總體積在15ml以下,最大腫瘤的直徑在3公分以下,伽馬刀的腫瘤控制效果依然安全良好。甚至某些癌症或是特殊情況下,超過10處甚至更多的轉移可能也可以享有良好的效果,以及比傳統全腦放射更低的副作用。
伽馬刀放射手術的新面向—惡性膠質瘤的應用
由於伽馬刀放射手術是利用精準的放射線作為治療工具,所以對於邊界模糊無法定義、或是瀰漫散布性的病灶,不適合使用伽馬刀來治療。腦部的惡性膠質瘤正是屬於這種情形,以往惡性膠質瘤幾乎只能接受一次傳統的放射治療,倘若腫瘤繼續進展則只能靠手術、化療、標靶等其他方式來控制。然而由於伽馬刀放射線集中的特性,對病灶外的區域影響很低,因此逐漸發展出另外的應用,例如可以做為腫瘤復發部位的補救治療,甚至有研究嘗試新觀念的腫瘤前緣放射治療。惡性膠質瘤是生長快速而且頑強的腫瘤,外科手術往往切除不及,腫瘤細胞早已朝病灶外擴散。腫瘤前緣放射治療即是以影像預先判斷腫瘤的前沿,以伽馬刀預先照射腫瘤可能擴散的方向以達到控制腫瘤擴散的目的。雖然這種新的治療方法還在進行更多的研究,卻也顯示伽馬刀在膠質瘤的治療上也有特殊的角色,更讓病患在對抗腫瘤時又增加一種治療的利器。
新式伽馬刀對於治療較大體積腦腫瘤及血管病灶的應用
在過去50年,伽馬刀已證明對於治療小體積腦瘤或血管異常病灶,有極佳的效果,但對於較大的病灶,僅能單次治療的傳統伽馬刀就無用武之地。然而隨著醫療影像及定位追蹤科技的大幅進步,伽馬刀也有了革命性的突破。新式第五代的伽馬刀ICON,使用新的技術,開始能夠執行分次的立體定位放射手術,對於不適合開腦手術或已開顱切除部分腫瘤,卻仍有較大體積腫瘤的病患,提供了一個很好的治療之道。最近陸續有不少文獻研究報告,傳來振奮人心的消息,使用分次伽馬刀放射手術治療較大體積腦瘤,其功效不亞於傳統伽馬刀治療小體積腦瘤的結果。所以未來新式的伽馬刀,還可以嘉惠更多的病人。
總結
伽馬刀放射手術發展至今已經超過70個年頭,新科技的發展已經讓伽馬刀從簡單的放射線聚焦原理,演變為電腦全自動治療的療程,先進的影像科技可以讓治療計畫更加精準與安全,結合術中即時影像定位,更給予了非頭架治療的彈性空間。新的醫療科技與藥物治療,不僅不會取代伽馬刀放射手術,反而能與伽馬刀互相搭配,擴展更多可以治療的適應症,讓伽馬刀能夠造福更多的病患,提供更好的生活品質。
腦瘤放射治療現況與新進展
本文出自癌症新探103期
臺北榮總 腫瘤醫學部 陳一瑋醫師
2023 元月 11
根據中華民國衛福部國民健康署最新癌症年報顯示,國人腦部一年好發各式腦部腫瘤約有七百例左右,其中新診斷的惡性膠質細胞瘤(Gliomas)約占七成(有四百多人),而腦膜瘤(Meningioma)則占另外三成。腦部腫瘤由於分布擴散均集中在腦與脊髓部位鮮有轉移侵犯至顱外部位,因此腦部腫瘤的惡性行為判斷,罕用期別分類,主要是以級別來判定腫瘤的惡性程度,根據國際世界衛生組織(WHO)針對腦瘤的分級中,主要分類為1-4級,其中1-2級屬低惡性度腫瘤偏良性表現。而3-4級由於細胞表現形態不佳,且對周邊正常組織有侵犯現象,因此列屬高度惡性組織,也是預後極度不良的族群。在所有的惡性腦瘤中又以第4級膠質母細胞瘤是成人最常被診斷的腦瘤型態,其高度預後不佳,復發性極高,是目前臨床醫學上較為棘手困頓的腫瘤疾病種類。而在兒童腫瘤分類統計中,腦瘤是兒童固態性腫瘤好發第一位,根據中華民國兒童癌症基金會歷年統計,國內一年約有100-150例該類兒童腫瘤罹患診斷。但是不同於成人腦瘤的狀況,兒童腦瘤的種類繁多,包括除膠質細胞瘤外,亦有髓母細胞瘤、中樞性生殖細胞瘤等特殊種類。但其發展預後較成人為佳,是需要積極介入處置的領域,並且需要兼顧治療後兒童在智力生長等各方面的發展。

在腦部腫瘤臨床治療的領域,依照腫瘤的特性可以選取不同治療的策略,主要包括手術、放射線治療以及藥物化學治療等種類。放射線治療是一種普遍而常用的腫瘤治療模式,特別是針對腦瘤這種高度對於正常神經組織內具有浸潤性的特性,放射性治療有加強治療的效果。
自1895年德國物理學家侖琴發現X光存在後,放射線即陸續廣泛被運用在腫瘤治療方面。早在30-40年前的放射線治療射源主要是透過鈷六十產生的伽馬射線,來進行腫瘤的破壞處置,由於劑量調控能力限制,以前的處置常造成病友有明顯的各式反應,包括在皮膚以及正常腦組織等。而時至今日主要則是採用調控精準的X光射線,進行腫瘤的治療安排,目前利用鈷六十的伽馬射線的伽馬刀的治療,有別於傳統放射治療,伽馬刀是高精準性的放射手術處置,透過大劑量少頻次(通常是一次),對較小體積的腫瘤區塊,進行高強度生物效益的破壞。而傳統標準的光子放射治療(目前是X光射束)主要原理是透過攜帶能量的光線針對腫瘤的組織,包括DNA以及蛋白質等物質,進行累積且持續性的破壞,所以需要一周五次,連續約六周左右的處置。透過低劑量連續累進的治療策略模式,不但可以有效保護正常神經組織不受傷害,亦可以達到腫瘤破壞的治療效果。臨床上很多非放射腫瘤領域醫療人員喜歡俗稱放射治療為“電療”,其實這是一個非專業性的誤名,因為真正放射治療並不是透過電流模式去電燒腫瘤來產生治療反應,反而常常因此造成病人及家屬對於放射治療的極高排斥心及降低接受度,強烈建議勿再使用此類誤名來誤導患者,應改正為專業的“放療”來簡稱,這樣才可以讓家屬及患者的治療接受度提升,因為真正在接受標準放射治療的5-10分鐘過程中,是一點電擊或疼痛的感覺都沒有的。
近年來由於醫學工程以及電腦網路系統的發達及進步,標準光子性放射治療的技術大幅提升,臨床上常常可以聽到各式各樣以“刀”來命名的各式放射治療的儀器及設備(如電腦刀、螺旋刀等),這些刀光劍影的命名方式,主要不是強調放射治療的侵入組織性,而是說明現今先進的放射治療儀器設計,可以將放射治療的劑量精準傳遞到腫瘤的部位,強調劑量分布跟腫瘤部位已達順型服貼的概念。有別於傳統鈷六十伽馬射線二維空間的早期治療技術,現在的放射治療針對腦瘤已經進入一個影像導引,三度空間劑量強度調控的高科技精準技術的時代。所謂影像導引是指因腦部腫瘤位於頭顱骨內,必須透過治療前即時的影像協助(如電腦斷層),才可以確認治療部位是否正確。另三度空間劑量強度調控主要意義是指腦部腫瘤深處顱內,往往周邊涵蓋極多的神經危急性的組織及器官,透過目前極為先進的三度空間立體治療技術可以安排射束避開危急性區域,並且利用直線加速器的機頭內纖細的鉛葉葉片即時提供射束的調控,可將同一出射的X光強度,進行不同等級部位的調整,讓射出的X光劑量分布可以依照腫瘤特殊性以及正常組織的安全性進行不同強度的安排。
另外近年最先進推出的放射治療技術弧形治療,主要是利用直線加速器的機頭可以在短時間之內進行360度迴轉,在迴轉的角度中依序進行纖細的劑量輸出,並針對腦瘤體積在不同照射角度下進行劑量調控,這樣不但可以大幅減少正常組織的傷害性,並可以集中射束於腫瘤部位,以達到精準照射的能力,是先進放射醫療的極致發展技術之一。
雖然目前標準性光子治療在腦瘤治療的技術方面十分先進,然現今光子性放射治療在腦部處置的發展及療效已經達到頂尖極限,有些對於光子有抗性的惡性腦瘤,即便在光子照射技術能力的高度突破之下,仍無法對於療效上有所提升,因此尋找開發有效的新式放射射源,如粒子性治療等,是現今放射治療急遽希望發展的方向。
台灣近年來各式粒子性放射治療的發展技術突飛猛進,主要集中在於質子治療技術的引進,質子治療的優勢在於其具有特殊劑量分布的優勢布拉格峰,質子的劑量在入射體內後並不會造成大量劑量釋放,而是在一定深度(如腫瘤部位)才會有高度劑量釋放,因此在腫瘤前端即腫瘤後端的正常組織並不會有治療劑量的傷害影響。因此質子主要的優勢在於正常組織的保護性,減少患者的傷害產生。然質子的生物效益(腫瘤破壞能力)與傳統X光相似,也就是傳統光子無法克服的特殊腫瘤,質子治療也無法有長足突破。
除質子以外,國內也引進重粒子治療(碳離子)模式,重粒子除了相似於質子治療具有布拉格峰的物理劑量分布優勢外,更具有高度腫瘤破壞的生物效益,是具有雙層腫瘤治療上的優勢,然近年國外研究顯示,重粒子治療較不適合執行於腦部腫瘤處置,主要的原因是重粒子由於生物效應較大,對於正常組織的傷害亦非常明顯(放射性腦壞死),因此國際上並不建議常規將重粒子治療用於腦瘤或兒童性腫瘤治療(易受傷害族群)。
腦瘤的新式突破性放射治療目前首推硼中子捕獲治療(BNCT),這個特殊的粒子性放射治療原理主要是透過專一投予腫瘤一個含硼-10的藥物(10是質量數,自然界80%主產是硼-11元素,硼-10是不帶放射性的同位素),之後施予腫瘤一個低劑量的熱中子照射,熱中子與硼-10結合後會分裂出高生物效益,具腫瘤破壞能力的α粒子,不但可以有效率爆破腫瘤,由於α粒子反應半徑極短僅侷限在一個腫瘤細胞內,對於周邊先前未攝取硼藥物的正常神經組織傷害極低,即便接觸到部分低劑量熱中子射束,亦不會造成重大傷害影響。硼中子捕獲治療的原理代表了一種優質的標靶性放射線粒子治療,目前設計專一性的含硼藥物載體是胺基酸(苯丙胺酸)的類似結構體,因此腫瘤會大量將此類必需胺基酸(人體無法自行合成)攝入,後續導致高腫瘤破壞效益產生。
有別於傳統光子、質子治療是必須,以人工定義腫瘤治療照射部位,硼中子捕獲治療是利用生物自動靶向來定義腫瘤範圍的,因此對於腦部惡性腫瘤浸潤的特性,可以有效予以標定,後續再選擇性的給予有效摧毀,這真的是一項非常具有優勢的腫瘤治療。硼中子捕獲治療自1950年代美國執行第一次人體腦瘤臨床試驗,目前已歷經七十個年頭,其中發揚光大並積極精進執行的國家是日本,目前日本政府已經於2020年三月起正式核可硼中子捕獲治療是正式癌症治療的處置方式之一,且具日本健保給付。雖然目前開放的首先適應症為復發頭頸癌,但是針對腦瘤的處置規劃是接下來努力發展的方向。
台灣自2017年三月起,透過與衛福部申請復發腦瘤患者的恩慈性治療,已獲核准,目前臺北榮總神經腫瘤團隊與清華大學原科中心合作,針對各式復發且已無其他積極治療可選擇的腦瘤個案對象,透過人體試驗委員會的特殊個案申請,已經執行超過120人次的緊急醫療安排,成效斐然,有超過一半以上的個案執行治療後具有腫瘤縮小的變化,讓這類極度無助挫折的腫瘤疾病,再度獲得一線生機。且治療後患者生活品質極佳,鮮少有嚴重不適的反應報告,是一個極度優勢的腦瘤粒子性放射治療選擇。
放射線治療是一個兩面刃,也像水一樣,水能載舟亦能覆舟。我們非常謹記放射治療領域的名言:永遠沒有治療不了的腫瘤細胞,只有耐受不了的正常組織。在安全保護正常神經組織的原則下,我們會謹慎挑選對於腦瘤患者合適且有效的放射治療模式,讓這類患者可以再次展開笑顏,迎接幸福美麗的人生。
碳離子放療對不可切除的結直腸癌非常有效
與現在廣泛使用的傳統X光射線放療相比,碳離子放療能夠提供更好的物理劑量分布以及更高的生物學效應,進而達到更高的局部控制率和更低的副作用。這項研究顯示碳離子放療對於不可切除的局部復發和傳統X光放療復發後的結直腸癌病例是一種非常有效且有未來性的替代治療,並且具有治癒病患潛力。雖然這項研究是一項回顧性分析,但病例數和追蹤時間是目前所有碳離子放療研究中最多的。
保羅
2023 元月 11
碳離子放射治療2022年時已在臺北榮民總醫院開始運作,不只是全台第一家,在全世界先進國家也是很少有這種治療設備,碳離子放療造價幾十億台幣,為什麼這種儀器值得這種花費。

對於無法切除、局部復發性結直腸癌病患接受化學治療或傳統放射化療的長期預後很差。根據文獻指出接受放射化療或傳統X光射線治療的病患3年總存活率是4到24%。因此碳離子放療成為一種潛在治療這些病患的方式。
曾經有四個國家的四個機構發表了關於碳離子放療療效的報告,因此病例數較少,而且追蹤時間較短,很難評估碳離子放療的總體結果或能夠來比較未經放療和傳統X光放療復發後再照射病例的優缺點。
日本國立放射線科學研究所--國立量子科學技術研究院在這方面積累了大量案例,因此利用這些資料來比較未經放療和傳統X光放療復發後再照射的結直腸癌病患的治療結果。
他們是將2003到2019年間在接受碳離子放療的無法切除局部復發性結直腸病患的資料進行回顧性的分析。病患接受每週4天,共16次的碳離子放療。未經放療病患的總照射劑量設定為73.6 Gy,再照射者的總照射劑量設定為70.4 Gy。所有治療都只使用碳離子放療,沒有同時接受化療。研究一共收納了390名未經放療和83名再照射病患,平均追蹤了48個月。
結果發現未經放療和再照射病患的3年總存活率分別是73%和76%;兩組的五年總存活率都是50%。3年局部控制率,這兩組都是80%;5年局部控制率分別是72%和69%,兩組都沒有明顯差異。而遠處轉移切除史也不會影響預後。在不良反應方面,在未經放療者中,發生3級或更高級別的早期和晚期毒性發生率分別為1%和5.9%。跟未接受放療者相比,先前接受過放療者發生3級或更高級別的不良事件發生率更高,有7.2%出現早期毒性,有26.5%發生了晚期毒性,但是所有的病患沒有死亡的不良反應發生。
總而言之,這項研究顯示碳離子放療對於不可切除的局部復發性結直腸癌的治療是一種非常有效且有未來性的替代方案,並且具有治癒病患潛力,包括之前接受過放療後復發的病患。雖然這項研究是一項回顧性分析,但病例數和追蹤時間是目前所有碳離子放療研究中最多的
直腸癌病患有福了!談談碳離子放療的療效
碳離子放療具有較高的線性能量傳遞、在抗輻射和缺氧細胞中誘導細胞死亡的能力更好,而且同時保留了正常組織不受輻射傷害。對之前未接受或者曾經接受傳統X光射線放療的局部復發性直腸癌病患,再接受碳離子放療是安全有效的,可以提供更好的局部控制和延長壽命。
保羅
2023 元月 11
雖然全直腸系膜切除術、傳統放療和/或化放療降低了局部復發的發生率,但是直腸癌局部複發仍然有4至13%,直腸癌以腺癌居多,術後復發缺氧細胞比例高,因此被認為具有放射抵抗性,尤其是復發的病灶常常靠近放射敏感器官,如腸道和膀胱等。

與傳統的X光射線放療相比,碳離子放療在更高的劑量定位特性和更高的細胞殺傷作用方面具有物理和生物學優勢,具有較高的線性能量傳遞、在抗輻射和缺氧細胞中誘導細胞死亡的能力更好,而且同時保留了正常組織不受輻射傷害。
在2021年日本國立放射線科學研究所及國立量子科學技術研究院(QST)在治療直腸癌術後復發這方面積累了大量案例。因此在2021年發表了未經放療直腸癌病患的療效報告。
研究從2001年至2016年間,共有 235名病患包含244 個病灶,因直腸癌局部復發接受了碳離子放療,平均年齡是60.9 歲,復發部位包括骶前區、骨盆側壁、會陰部和周圍軟組織。接受碳離子放療的總劑量是67.2至73.6 Gy,並在4週進行16次治療。
所有244個病灶的局部控制率在3年和5年分別是90%和88%,235名病患的總存活率3年和5年分別是67%和46%。目前臨床使用73.6 Gy的203名病例中,5 年局部控制率和總存活率分別為89%和52%。因此病患接受碳離子放射治療是直腸癌手術後局部復發管理的一種安全有效的治療方法,可以有更好的局部控制和存活率。
在不良反應方面,一名病患發生3級的胃腸道潰瘍的早期毒性,沒有觀察到其他嚴重的急性反應。另外也觀察到兩名病患發生3級皮膚損傷和一名病患發生3級胃腸道阻塞的晚期毒性。
研究人員也回顧性分析了2003至2014年日本其他三個重離子放療機構接受碳離子放療的224名病患的資料,平均追蹤時間是62個月,3年和5年總生存率分別為73%和51%; 3年和5年局部控制率分別為93%和99%。在不良反應方面,分析結果顯示發生早期或晚期毒性與他們的研究結果相似。
2022年他們又針對曾經接受傳統的X射線放療後復發的直腸癌病患接受碳離子放療的療效報告,因為這一類病患很難再接受傳統的放射治療,因為腫瘤周圍的正常組織無法再承受輻射的傷害。因此這77名病患接受了碳離子放療,所有病患都接受過平均劑量50.0 Gy的傳統的放射治療,再接受碳離子放療總劑量是70.4 Gy。
結果發現總體局部控制率3年和5年分別是69%和62%,其中在控制計劃目標體積內復發率分別是90%和87%;區域復發控制率在3年和5年分別是85%和 81%。而且沒有病患在接受碳離子放療後接受手術切除。平均總存活期是47個月,3年和5年總存活率分別為61%和38%。在不良反應方面,有8名病患發生急性3級毒性,有16名病患出現了晚期3級毒性,但是沒有發生4級毒性。
因此對之前接受X光射線放療的局部復發性直腸癌病患,再接受碳離子放療是安全有效的,可以提供更好的局部控制和延長病患壽命。
惡性腫瘤腦部轉移的治療
本文出自癌症新探103期
新光醫院 腦神經外科/外傷科 陳慶霖主任
2023 元月 05
身體其他器官的惡性腫瘤,經血流侵犯到腦部,稱之為[惡性腫瘤腦部轉移],大腦最多占了80%,其次為小腦、硬腦膜…等;癌症原發部位最常見的原發癌為肺癌,其次乳癌、腸胃道癌等等。轉移時間長久及腫瘤增長的速度仍尚未有確切的定論。
轉移性腦瘤最常見的症狀,其實是沒有症狀。當腦瘤長得夠大或腦瘤周圍發生水腫或是轉移到腦的運動區或言語區或壓迫到腦神經,導致神經學的障礙,症狀就顯現出來,例如:腦壓昇高導致頭痛、嘔吐尤其是睡醒的清晨間頭痛或單側手腳無力、言語障礙、個性改變甚至癲癇。
惡性腫瘤侵犯身體器官加上轉移至腦部,會加重病情及其預後。所幸因為生物科技的蓬勃發展,加上科技的進步,使得轉移性腫瘤不再是一籌莫展、絶望的疾病。
轉移性的腫瘤的治療分為下列幾種:
1.開刀治療
當腫瘤大到腦部無法承受壓力時,腦壓就會昇高,造成病患頭痛、噁心、嘔吐及神經的障礙。如果只有單顆腫瘤或是其中的一顆腫瘤所造成,手術治療是最快最有效的方式,也可以將切除的腫瘤做組織病理的研究,了解何種癌症及其種類,透過基因的檢查、對藥物的耐受性來決定追加治療的依據,只是連帶有麻醉及手術的風險,需要仔細的評估。
2.放射線治療
轉移性腦瘤原發癌症是經由血流跑到腦部,常常有多個腫瘤,所以需要放射治療的輔助性療法。
(1)全腦放射
可以減緩腫瘤的復發及長大,但效果不甚太好,可能造成病患往後的認知障礙,提早腦部老化的到來。
(2)立體定位放射治療
經由三度空間、電腦精準定位,可將單次或低分多次(3-5次)高劑量輻射直接照射到單顆或多顆腫瘤上,像烏俄戰爭的精準飛彈般,直接命中病兆,大幅減少周遭的傷害,逹到類似開刀切除的效果,現行臨床治療有多種儀器,例如:伽馬刀、電腦刀、螺旇刀、光子刀…等,不同種類有不同的優缺點,需要專業醫師給予詳細評估使用。
(3)抗癌藥物治療
轉移性腫瘤和原發器官的癌症,可能有不一樣的基因背景,最好是取得病理組織切片作基因或其他的檢測,找出有效的化學藥物的治療。近期發展出效果不錯的標靶治療、免疫療法、細胞療法及其他化學藥物治療。也有正在研究中的電射腫瘤種熱療及腫瘤治療電場療法,期待未來有更好的結果。
早期認為己經有轉移性腦瘤,就是絕望沒救了,隨科技及生物科技的快速發逹,使得病患有更好生存機會及更好的生活品質。轉移性腦瘤從身體原發器官的癌症而來,病患年齡、身體狀況、原生癌症的惡性期別和轉移大腦的位置,導致治療方式及預後的極大複雜及變異性,要不要開刀或者開刀加入放射治療或者需不需要加抗癌藥物,仍有賴和專業醫師及其團隊討論,共同決定。
癌症病患要檢測新冠病毒抗體反應嗎?
癌症病患,特別是血液惡性腫瘤接受疫苗接種後可以檢測新冠病毒的抗體反應,幫助自己了解抗體反應、感染風險和採取預防措施,譬如戴口罩、保持社交距離、洗手及避開人潮和通風不良的室內空間,都能降低感染和傳播的風險。此外,這一類病患,雖然接種疫苗後的抗體反應比較低,但是仍然強烈建議接種新冠疫苗及增加接種疫苗次數至少3次以上。即使抗體反應不明顯,仍然可以引發T細胞的免疫反應來增加抗病毒效果而能減少感染後的症狀。
保羅
2023 元月 05
新冠病毒(COVID-19)感染爆發,台灣也將迎來第三波的流行,我們也持續關心台灣癌症病人接種新冠疫苗的效果,雖然以前也有幾篇研究文獻,但內容不是很完整。
對於免疫功能低下的癌症病患,接種新冠疫苗後容易產生突破性感染與癌症的種類有關嗎?還是與接種疫苗後的抗體反應有關呢?
英國牛津大學博士Lennard Y. W. Lee博士和他的同事為了了解癌症病患產生新冠病毒突破性感染或住院風險是不是和接種疫苗後的抗體反應有關,如果兩者有相關性。是不是讓病患接受抗體測試後可以採取額外的預防措施來降低感染風險。
研究利用了英國「國家冠狀病毒癌症抗體調查」資料,分析了3555名癌症病患的4249項SARS-CoV-2刺突蛋白抗體檢測結果,並與對照組225,272 名非癌症病患的294,230項檢測結果互相比較,其中61.22%是女性,38.78%是男性,白人佔93.72%。抗體測試在第二次或第三次疫苗接種後進行。
結果發現與沒有罹患癌症的對照組相比,癌症病患更有可能出現檢測不到的抗尖峰抗體反應,兩組分別是4.68%及0.13%。在癌症組和對照組中,接受第三次劑量的個體的抗體滴度明顯高於僅接受兩次劑量的個體(受試組是11,146.5 vs. 8765 U/mL,對照組是23,667 vs. 12,126.0 U/mL),沒有罹患癌症的對照組在接種第二次和第三次疫苗後產生的抗體滴度都比癌症病患高。
以癌症分類來看,白血病或淋巴瘤病患的抗體濃度最低,有高達19.23%沒有檢測到的疫苗抗體反應,實體腫瘤病患是4.23%,不過對照組最低只有0.13%而已。而接受全身抗癌治療和晚期癌症(第四期)的病患比起第一期跟到第三期的病患呈現更低的抗體濃度。
將多變數調整後發現,與抗體反應陽性的病患相比,抗體反應檢測不到的癌症病患發生新冠病毒突破性感染風險增加了3.05倍,住院治療風險也增加6.48倍。
總而言之,這一項研究顯示,癌症病患,特別是血液惡性腫瘤可以使用新冠病毒抗體檢測疫苗接種後的抗體反應,幫助病患了解自己的感染風險和採取預防措施,如戴口罩、保持社交距離、洗手及避開人潮和通風不良的室內空間,都能降低感染和傳播的風險。
雖然癌症病患,特別是血液惡性腫瘤,接種疫苗後的抗體反應比較低,但是仍然強烈建議接種新冠疫苗及增加接種疫苗次數至少3次以上。即使抗體反應不明顯,仍然可以引發T細胞的免疫反應來增加抗病毒效果而能減少感染後的症狀。
乳癌病患術後乳房重建會增加淋巴瘤的風險嗎?
乳房切除術後的乳房重建對許多女性的生活品質非常重要,雖然發生間變性大細胞淋巴瘤 (ALCL) 的風險略高於一般正常人,不過仍然屬於罕見疾病。避免使用具有高表面積的特定品牌的宏觀紋理植入物可能可以減少ALCL發生。
保羅
2023 元月 05
美國每年診斷出約291,000例乳癌和51,000例導管原位癌,其中大部分接受局部根治性手術,包括乳房切除術和乳房重建,乳房重建也就是俗稱的隆乳。乳房重建使用的乳房植入物有兩種,一種是表面光滑,另外一種是表面有紋理,比較粗糙,使用表面粗糙的乳房植入物可以保持在原來的位置不容易移動變形。

近年來可能因為越來越多使用紋理面乳房植入物來重建,而間變性大細胞淋巴瘤(ALCL)的發生率也跟著增加,雖然ALCL是一種免疫系統癌症,不是乳癌,而是一種與乳房植入物相關的罕見癌症。但是對於接受乳房切除術的乳癌病患可能想知道接受這種重建手術的好處是否值得冒第二種癌症的風險。
但是到目前為止,還沒有專門研究乳房切除術後接受植入物重建 的女性發生ALCL風險的相關研究。因此哥倫比亞大學Vagelos內外科醫學院放射腫瘤學的Kinslow和Horowitz醫師最近進行了接受植入物重建的女性中引發ALCL的風險的分析。
研究使用了美國國家癌症登記處2000年至2018年間57,000名接受癌症定向乳房切除術和植入物重建女性病患資料,中位年齡在45至50歲,18%罹患導管原位癌,72%罹患侵襲性乳癌。這些病患有7%是亞洲或太平洋島民女性,8%是黑人女性和84%的白人女性。平均追蹤時間是7年,約有16,000名女性被追蹤更久,超過10年。
結果顯示在421,223人年中診斷出5名ALCL,其中有一名是T细胞淋巴瘤-非特指型。進而推算出發生率在每年每百萬人有11.9人,比預計普通人群中每百萬人中只有0.3人還高,但是仍然屬於罕見疾病。
不久之前美國食品和藥物管理局(FDA)也追蹤ALCL的全球病例。截至2020年1月5日為止,有733例已知病例和36例死亡報告。因此對於接受乳房植入物的女性來說,這代表風險非常小。
數年前FDA認為大約85%的ALCL病例發生在接受某廠牌紋理面乳房植入物的女性中,因此該公司已停止提供這些乳房植入物,法國也撤銷了此廠牌紋理乳房植物安全許可。
目前認為可ALCL可能與紋理面的乳房植入物有關,所以目前建議病患接受重建手術時避免使用具有高表面積的特定品牌的宏觀紋理植入物可以減少ALCL發生。
而這一項新研究應該會讓許多女性更容易做出決定是不是要進行乳房重建,根據此研究手術後發生ALCL的風險極低,對於許多女性來說,乳房切除術後的乳房重建對生活品質非常重要,使用表面光滑乳房植入物進行乳房重建就不會增加心理負擔。
認識惡性原發神經膠質瘤
本文出自癌症新探103期
臺北榮總 一般神經外科 許秉權主任
2022 十二月 28
腦瘤的類型根據來源不同可分為 1.原發性腦瘤及 2.次發性腦瘤即其他部位的癌症轉移到腦部,例如:肺癌、乳癌等。原發性腦瘤以神經膠瘤最為常見,佔所有腦瘤患者約43.9%,包含神經膠質母細胞瘤、星細胞瘤、寡樹突膠質瘤與室管膜瘤;其次為腦膜瘤,約佔 17.2%,較常發生在婦女,八成以上屬於良性腫瘤主要可以經由手術方法摘除。此外,腦下腺瘤佔 8.6%,許旺氏瘤佔 7.0%,其他如先天性瘤、血管瘤則佔少數。很不幸的,神經膠瘤幾乎都是惡性的,尤其好發於成人的神經膠母細胞瘤以及小孩的髓芽細胞瘤,其惡性程度特別高。本文主要針對高惡性原發神經膠質瘤治療作介紹。

惡性膠質瘤診斷
除了神經症狀理學檢查,惡性神經膠質瘤最重要診斷工具就是影像檢查及手術病理報告。影像檢查最重要就電腦斷層掃描(CT)及磁振攝影(MRI)。懷疑腫瘤的病人在做照影前必須打顯影劑,顯影劑可以幫助我們分辨腦組織的細微不同處。CT如有異常發現則必須進一步做更精準清晰的MRI。因為它可以看穿顱骨及其它的組織,特殊的訊號或光譜分析也可幫助我們偵測腦瘤範圍及成分。MRI比 CT 敏感,尤其小的腫瘤更重要。此外腦下垂體微腺瘤要用 MRI 做灌流攝影。MRA(MRI 之血管攝影)也取代許多傳統腦血管攝影檢查。MRI可同時看見腫瘤與血管,對手術導航定位極為重要。
惡性膠質瘤正規治療
惡性神經膠質瘤除非是位於手術極端危險困難的位置,否則影響預後存活時間最重要因子之一就是手術治療,而且手術必須在安全範圍下做最大的切除,已有許多證據顯示腫瘤切除率越高復發間隔及存活時間越久。因此因過度擔心手術後遺症而採取保守的切片加放射線及化學治療對預後幫助不大。為增加腫瘤切除率有些複雜手術或經驗不足的醫師會使用術中影像導航,或是術中螢光顯影幫忙確認腫瘤邊界。而為增進手術安全,除了術中影像導航,最常用的工具是術中神經功能定位與監測,主要是用來定位監測運動功能區或腦幹等重要功能區域。有時配合喚醒手術,可以增進語言功能保留。不論什麼工具,唯有真正受過腦手術次專科訓練對腦解剖及手術觀念清楚正確的神經外科醫的經驗,才是手術安全成功的保障。國內真正專心從事腦瘤手術且手術量大的神經外科醫師只佔約百分之十,病患接受手術前絕對必須慎選醫師。
高惡性神經膠質瘤術後如為第四級神經膠質母細胞瘤,需行同步放射及口服帝盟多(temodal)化療,即放射治療三十次輔以低劑量帝盟多化療,休息四週後予以每四周五日的高劑量帝盟多化療共六至十二療程。期間每三個月行核磁共振造影追蹤以期早日發現腫瘤復發。腫瘤一旦確認復發,再次施行手術仍是預後重要因子。術後則需行靜脈注射健保給付癌思停標靶治療。若為第三級惡性退行性星狀細胞瘤或寡樹突星狀細胞瘤,一般建議予以放射治療,某些預後因子如IDH-1若無突變,則預後差,視為第四級神經膠質母細胞瘤,須考慮同時帝盟多化療。有時術中若病理冰凍報告為高惡性膠質瘤,可考慮自費行BCNU gliadel wafer 術中化療,將藥片貼在腫瘤切除後的腔壁上,術後一段時間藥物會直接近距作用控制腫瘤。低惡性膠質細胞瘤原則以手術全切除為主,不需放化療及標靶治療。帝盟多常見副作用為噁心、嘔吐、血球數低免疫功能下降。而癌思停標靶治療副作用則有高血壓、出血、傷口癒合不良等問題。
惡性膠質瘤預後因子
高惡性神經膠質細胞瘤治療已進入精準醫療時代,有些預後因子是術後治療重要參考。惡性神經膠質細胞瘤最重要的預後因子,除手術切除率外,就是分子生物標記。如前述,IDH-1基因有無突變是預後及腫瘤分類重要參考。有突變則預後佳,若為野生型無突變因預後差,除標準術後同步放化療外,有時第一線會考慮自費癌思停標靶治療,以期能更有效控制腫瘤復發。另一個重要生物標記為1p19q染色體聯合缺失,有缺失預後佳,多發生在寡樹突膠質細胞瘤。再來還有MGMT 甲基化表現,有甲基化代表腫瘤細胞受帝盟多治療受損後較無修復能力,因此預後較佳。另外還有MIB-1指數,指數越高代表腫瘤複製能力越強,越容易復發。
惡性膠質瘤復發之後線治療
高惡性神經膠質細胞瘤若已接受正規手術、放化療甚至癌思停標靶治療後仍復發,則須考慮後線治療,其中有較強療效的包括根據CGP (comprehensive gene profiling)基因檢測之標靶精準醫療、BNCT硼中子捕獲治療及TTF腫瘤電廠療法治療。目前國內外有多家生技公司平台可施行全方位數百種腫瘤基因分析,根據基因型表現結果及作用機轉,會有相對應標靶藥物治療。除恩慈療法和臨床藥物研究,雖然大部分標靶藥物都是自費,但仍是惡性膠質瘤重要後線治療。目前台北榮總腦瘤多專科團隊已常規施行CGP精準治療,基因庫及治療個案數為亞洲先驅。
硼中子捕獲治療的模式用來治療惡性腦腫瘤,其主要原理是透過專一投予腫瘤細胞一個含硼-10藥物,後施予低劑量熱中子照射,硼-10在與中子結合後會裂解成兩個高生物效益的粒子,氦核與鋰核,這些粒子可以以高效能來破壞腫瘤細胞,但破壞範圍僅侷限在一個腫瘤細胞範圍(5-10μM),因此是一個優質的腫瘤粒子標靶治療模式,特別是針對浸潤性腫瘤,可以進行徹底的腫瘤殲滅與破壞。近年來由於含硼藥物專一性的突破開發,再加上各式中子射束的提供能力提升,逐步讓硼中子捕獲治療邁向實際的腫瘤臨床醫療。
腫瘤電場療法(TTFields)是一種干擾癌細胞有絲分裂的治療。TTFields以非入侵性方式,輸出低強度交變電場,破壞紡錘體的形成,影響癌細胞分裂時染色體的自然分離過程,令活躍的癌細胞在有絲分裂時出現錯誤,從而凋亡。正常細胞和癌細胞對不同頻率的電場有不同反應,因此透過準確設定頻率,正常細胞基本上不受電場影響。此外,TTFields亦會對腫瘤微血管產生影響。微血管除了將氧和營養素輸送到腫瘤中,也間接影響腫瘤內免疫抑制環境。研究數據發現,TTFields可以通過阻斷腫瘤營養供應和改善腫瘤內的免疫環境,促使腫瘤消退。
惡性膠質瘤尚待突破療法問世
拜醫學發展所賜,細胞及免疫療法甚至幹細胞治療已蓬勃發展於各癌症領域,但因機轉不同及獨特腦組織之顯微環境因素,目前這些新式療法皆未有用於腦癌治療療效的證據。然而一些病患及家屬病急投醫,或是捨棄正規治療,或是正規治療無效而尋求尚未成熟療法,動輒花費數百萬元,殊為可惜。國內每年有超過一千人死於腦癌,即使經過開刀和放療,還是有八成的患者會在病發後的一年內死亡。低度分化的星狀細胞瘤或寡樹突膠質瘤患者的平均存活時間約六到八年。第三級退行性星狀細胞瘤患者的平均存活期間約為三年。然而,神經膠母細胞瘤患者的平均存活時間則只有約 12 到 18 個月,本院存活時間可達22個月。因腦癌預後差,加上伴隨神經功能障礙,得病後所產生的心理支持系統、昂貴藥物給付、復健及慢性照護問題皆有賴政府,學會及病友會一起面對解決。
注意!抽菸特別是電子菸對牙齒和牙齦有害
捲菸、電子菸、雪茄、菸斗、水煙袋的癮君子可能會增加包括牙齦疾病、口腔癌前病變、牙齒周圍的骨質流失、牙齒鬆動、由於蛀牙或牙齦疾病而導致的牙齒脫落等六種不同的口腔健康問題的風險。
特別是被認為最安全的電子菸,短期內就會引發口腔炎症,這代表電子菸引發口腔疾病的風險遠高於傳統的菸草。
保羅
2022 十二月 28
抽菸沒有任何好處,不但會引發癌症,同時也會對口腔健康產生不良的影響。美國國家衛生院(National Institutes of Health,NIH)國家藥物濫用研究所與美國食品和藥物管理局(U.S. Food and Drug Administration,FDA)菸草製品中心從2011年開始合作進行一項關於美國煙草使用和健康的大型長期研究「煙草與健康人口評估」(Population Assessment of Tobacco and Health,PATH),並在2013年開始收集資料。

透過追蹤這些研究參與者,PATH研究幫助科學家了解人們如何及為什麼開始使用煙草(包括捲菸、電子菸、雪茄、菸斗、水煙袋和/或無煙菸草)、戒菸、並在戒菸後又重新開始抽菸,及隨著時間的推移抽菸如何影響健康如心血管和呼吸系統健康,特別是2009年電子煙開始進入市場,電子菸對牙齒健康的影響。
2022年NIH的Marushka L. Silveira博士和他的同事發表了最近PATH研究結果,他們分析了2013 年至 2019 年收集的三到五年的追蹤資料。
主要是過去12個月自我報告的牙齦疾病、癌前口腔病變、牙齒周圍骨質流失、刷牙或使用牙線後出血、牙齒鬆動及拔掉1顆或多顆牙齒等6項,追蹤了約10,000至16,000名男性和女性,其中約16%至19%經常抽菸,而2%至3%的人分別抽雪茄或無煙菸草。
研究發現,與在同一時間內不抽菸者相比,抽菸者報告牙齦疾病和口腔癌前病變分別增加了33%和118%、牙齒鬆動的風險高出35%。使用捲菸者報告因蛀牙或牙齦疾病而拔掉一顆或多顆牙齒的風險也高出43%,水菸使用者接受這種牙齦疾病診斷風險比不使用者高出了78%。被視為一種更安全的菸草使用形式的電子菸,也發現會增加刷牙或使用牙線後出血的風險27%。而鼻菸和無煙菸草(鼻菸除外)與口腔健康之間則沒有關聯。
捲菸、電子菸、雪茄、菸斗、水煙袋的癮君子可能會增加六種不同的口腔健康問題的風險,包括牙齦疾病、口腔癌前病變、牙齒周圍的骨質流失、牙齒鬆動、由於蛀牙或牙齦疾病而導致的牙齒脫落等。
其中要特別注意的是被認為最安全的電子菸,曾經有研究顯示將吸電子菸僅五個月者的牙齒健康與抽菸至少五年者相比較後,發現使用電子菸者的口腔炎症量與抽菸五年者一樣多,這代表電子菸引發口腔疾病的風險遠高於傳統的菸草。
所以最好是戒菸,特別是電子菸,很多年輕人認為抽電子菸是一種時尚的行為,但事實上,電子菸對健康產生危害風險非常高。
對同側多發性乳癌進行乳房保留手術會增加復發的風險嗎?
同一側乳房有多發腫瘤接受「乳房保留手術」及放射治療的病患五年局部復發率只有3.2%,復發率與先前文獻中針對單個乳房腫瘤病患接受乳房保留手術的局部復發率相似。這一類病患可以考慮將「乳房保留手術」作為一種治療選擇。
保羅
2022 十二月 28
局部性單一腫瘤的乳癌病患進行乳房手術有兩種選擇,一種是切除整個乳房的「乳房切除手術」,一種是「乳房保留手術」。「乳房保留手術」只切除癌變區域和少量周圍正常組織,加上放射治療以根除任何微小殘留病灶,目前文獻顯示兩者在總存活期沒有區別。
而大多數在同一側乳房出現兩個或三個乳癌腫瘤的病患都被建議接受乳房切除手術,因為依據以往的回溯性研究顯示乳房保留手術的局部復發率很高。然而,同側多發性乳癌的乳房保留手術的安全性過去未在前瞻性研究中得到證實。

美國明尼蘇達州mayo clinic的Boughey博士和他的研究團隊在ACOSOG Z11102 第II期臨床試驗中探討這個問題。
他們評估同側多發性乳癌病患在接受手術前進行磁振造影或先以輔助荷爾蒙治療來檢測和最小化局部復發的風險,並且分析病患的年齡及局部腫瘤的數量與接受「乳房保留手術」後是否有互利關係。
研究招募了年齡超過4 0歲且有兩個或三個小於5公分乳癌腫瘤的女性病患,其中至少1 個是浸潤性腫瘤,而且腫瘤彼此間的距離大於2到3公分。大多數患者在接受手術前接受了乳房磁振造影檢查。從2012年7月至2016 年8月共有236名符合條件的病患參與了此研究,可完成評估204名病患中,其中195人完成了放療,平均61歲,有 6名在追蹤66.4個月後出現局部復發,5名是同側乳房,1名是胸壁。五年局部復發率為 3.2%。復發率與先前文獻中針對單個乳房腫瘤病患接受乳房保留手術的局部復發率相似
與接受術前磁振造影檢查的189名病患相比,未接術前磁振造影檢查5名病患的5年內局部復發風險增加了13.36倍,這可能是因為接受乳房磁振造影檢查能在手術前能更好檢測到疾病部位而達到徹底切除。試驗中沒有患者出現區域性復發,有4人發生遠處復發,6人在對側乳房發生乳癌,3人發生新的非乳腺原發性腫瘤。其中8人死亡,與乳癌相關死亡有1人。研究也發現局部復發的風險與病患年齡、乳腺病變數量、腫瘤生物學或病理分期類別無關。
總而言之,從這一項前瞻性II期臨床試驗來看,同一側乳房有多發腫瘤並接受乳房保留手術和放射治療的病患在局部復發率與歷史上觀察到的單一腫瘤患者相似,這一類病患可能可以考慮將「乳房保留手術」作為一種治療選擇。
淺談成人惡性腦瘤分類與預後
本文出自癌症新探103期
三總醫院 神經外科部腦腫瘤醫學科 馬辛一主任
2022 十二月 21
這是一篇為了普羅大眾、一般庶民,也就是「非專業的神經腫瘤科或基礎研究學者」所寫的文章。重點在嘗試用淺顯易懂的文字來介紹這個令人沮喪、無助但又充滿了希望的疾病。全篇不強調統計數字及分子生物學及基因標靶等醫學專有名詞而使用非專業的文字來描述惡性腦瘤概念上的問題,讓一般庶民普羅大眾了解這個死亡率很高的癌症,不要畏懼而能戰勝惡性腦瘤。

腦部腫瘤分類:世界衛生組織將腦部腫瘤分為九大類,包括神經上皮腫瘤、腦膜瘤、神經腫瘤、血液性腫瘤、生殖細胞腫瘤、囊腫、蝶鞍腫瘤、其他腫瘤之局部侵犯、及轉移性腫瘤。惡性腦瘤是一個生長在腦部(即中樞神經系統)、結構複雜的、浸潤型的(也就是像榕樹根向四面八方延伸蔓延生長一般),而且和正常的腦組織之間沒有明確清楚的界限區分的;且內部組織大部分為壞死的爛肉組織、湯湯水水,外觀非常多樣化的一個腫瘤。約佔所有原發自腦組織的腫瘤的一半、而且多半不是發生在青年人就是在中老年人。這種惡性腫瘤(腦瘤)絕大多數都生長在顱內腔,幾乎或很少會轉移到顱內腔以外的肝、腎、肺及消化系統等器官(這和其他的癌症大異其趣)。但有很高的比例,這種惡性腫瘤會沿著腦內的白質纖維而跑到同側或另外一側的腦組織中。因著胚胎發育來源的不同而分別有來自於星狀細胞改變而來,也有自寡樹突神經膠質細胞而來,但進展到所謂第四級後(就是多型性神經膠質瘤;GBM)其組織型態也沒什麼太大的差別,只是生長迅速、進展活躍,病人存活時期都不長。惡性腦瘤產生的原因目前在臨床上仍無明確的病因,可能是好幾個因素一起作用而引起。科學界認為由於化學、物理、或分子生物學中一些基因發生突變是主要原因,與一般癌症的起因完全相同。某些少見之遺傳性疾病病患,有較高惡性之腦瘤發生率。
以流行病學研究上的「台灣癌症登錄」的來說(國健署每年出版的癌症登錄資料),惡性腦瘤的發生率及死亡率不在十大癌症死因之內,且好發之機率比一些列管之罕見疾病還要少,但死亡率卻名列前茅。這表示雖然每年新病人不多(每2300萬人口有600多人),但超過2/3已往生。不論多努力治療,其一年存活率也不到三分之一,而且發生殘障、失能、甚至腦殘、植物人之機會也很大。
腦部腫瘤之臨床症狀:以局部侵犯、壓迫、出血等,導致顱內壓升高為主,故視腫瘤大小、位置、生長速度快慢不同而有差異,其中以頭痛(54%)、肢體無力(45%)及癲癇(26%)最為常見。因為人類的腦部是一個分工精細且在功能上環環相扣、迴迴相連的脆弱組織,沒有一塊部位是多餘的、不重要的、沒有功能的,舉例來說:只要運動區附近有了腫瘤生長,病人一定發生對側肢體無力(癱瘓或偏癱);視覺區附近或腦下垂體附近長了腫瘤,就一定會影響到視力、視野;額部長了腫瘤就一定會影響到病患的脾氣、個性及人格特質,藉由其詳實的神經學檢查便可以「定位」腦腫瘤所在地的原因。惡性腦瘤的症狀依其在大腦內的位置及大小而定。且惡性腦瘤症狀的產生與鄰近腦組織受壓迫的輕重嚴重度有關。因為顱骨腔為一堅硬的有限空間,當惡性腦瘤發生在顱腔內時,會因壓迫腦組織或浸潤腦組織而產生局部症狀。大腦的惡性腦瘤依其生長的部位可能會造成肢體無力、視覺異常、偏癱、抽搐等;而腦組織受到惡性腦瘤的刺激而產生不正常的放電則會發生癲癇症;另外腦下垂體或下視丘部位腫瘤可發生內分泌異常症狀。小腦的惡性腦瘤易造成運動與平衡功能受損,導致運動失調或步態不穩。若惡性腦瘤影響到腦脊髓液的流通,則易造成水腦症。部份良性腦瘤因生長緩慢,早期往往沒有症狀,等腫瘤增大後才產生症狀,但有些聽神經瘤在腫瘤很小即有神經症狀,如耳鳴或聽力障礙等。腦瘤常發生的症狀包括:頭痛、噁心、嘔吐、肢體無力或感覺障礙、內分泌異常症狀(如泌乳症、尿崩症、月經失調、肢端肥大、庫欣氏症候群等)、抽搐(癲癇)、視力障礙或眼球運動異常、耳鳴或聽力障礙、意識、記憶力、說話能力障礙或人格變化或運動失調或步態不穩等等。可以說是「千奇百怪」「無奇不有」。
但精確的定位及診斷則需依賴放射影像學上之檢查證據,比如電腦斷層、磁振攝影(MRI)甚至核子醫學上的正子攝影。其中主要是要檢查看看腦部有沒有因為長了腦瘤而造成腦水腫或出血或因為長了腫瘤而影響到腦脊髓液流通所致的水腦,這個時候使用電腦斷層這個工具去做檢查,是又快又好;但若要研判腦瘤本身的問題,則非磁振攝影不行(其中也包含了MRA、MRV、MRS、fMRI、DTI、DWI、ADC等等),甚至還要加打顯影劑才可以看得更清楚。若需了解惡性腦瘤內部代謝上的問題,有時尚需做正子攝影才夠。
惡性腦瘤治療方式的決定非常複雜,取決於許多不同的因素,包括惡性腫瘤之病人年紀、身體狀況、病理型態、位置、大小等等。治療之方法及順序亦因小孩及大人有所不同,應依各人不同之需求設計治療計劃。
腦瘤的治療方法包括手術切除、放射治療及化學治療,視病人的情況,需經多科專家之討論,以決定治療方式。參與治療的專家包含神經外科、放射診斷、放射腫瘤、內科腫瘤等專科醫師,病人也有可能需要復健治療或內分泌治療。還有護理師、營養師和社工人員也常需參與照護。
現在影像醫學進步神速,甚至在手術前也可以做3D立體定位或導航之設定,不但可以在三度空間中精密的刻畫出腦瘤之位置(包含形狀、直徑、體積大小及精確的位置),若再加上導航定位系統則更可以在手術中避開重要的血管及顱底神經等重要結構(腦瘤的手術在概念上一定是微創的,且必需使用專用的手術用顯微鏡;甚至需使用特殊波長的螢光及血管內螢光劑注射如 ICG等特殊藥劑),在放大10至20倍的影像下切除腦腫瘤。也就是說,現代的腦瘤手術切除過程中必須在手術前建立好精確的3D導航設定,再配合一些特殊設計的工具(比如手術用顯微鏡及一些手術工具及顯微器械),才能在較安全的情況下進行該項高難度、高風險之手術。甚至在手術過程中還會應用上一種特殊的螢光染劑(先經過靜脈注射後,再透過手術用顯微鏡的特殊模組,在特定波長的紫外線照射下,惡性腫瘤的組織可以放出朱紅色的螢光),這樣就可以把殘存的惡性腦瘤組織及細胞做更徹底的清除。
現今顯微鏡的器械及切除腫瘤之工具皆日新月異,所以在廿一世紀的現在,「腦瘤切除」這項高危險、高難度的手術,已較過去十幾年進步許多,而且手術及麻醉的風險亦降低了。在接受治療時,部分病人可能需接受類固醇或其他降腦壓藥物治療水腫,或抗癲癇藥物以控制癲癇發作甚至低體溫治療。若水腦情形出現,必要時可進行腦脊髓液引流術,以一條細管連接腦室,將過多的腦脊髓液引流到腹腔或體外。
以現今惡性腫瘤之治療方法,手術(開刀)仍是佔有首席之地。有些手術指的是開顱術(也就是將頭顱骨鋸開,再切除腦瘤),也有鑽顱術(在頭顱骨上鑽一個小洞,再以細針等精細工具取出具代表性之腦瘤標本)。正確而有代表性的腦瘤標本於中樞神經系統中所生長的腦瘤,在治療方向上非常重要,甚至可以說是最關鍵的一項指標。受過專業訓練的神經病理學家就依據這些珍貴的標本來做病理診斷,包括一般染色、免疫染色、分子生物學中之各種分子標靶,甚至基因的微陣列分析等,務必找到最正確的分類及分子特色做為後續化療、放射治療等治療之基礎。在中樞神經系統腫瘤中,可以說沒有正確的病理診斷就沒有正確的治療,甚至無法判斷預後,這點非常重要。而取得的標本是否正確而具代表性,則是神經外科專科醫師無可規避的重大責任。如果所採樣的標本位置不正確,則絕對是個悲劇。
一般被認為必須考慮腦部腫瘤手術的有顱內高壓,需立即減壓救命者;界線清楚,可完全切除者;界線不清楚但為低惡性度腫瘤;高惡性度腫瘤,併明顯之神經壓迫,術後可改善者。
腦部腫瘤手術後有可能有許多併發症如下:1. 腦內出血。2.腦中風。3.腦水腫與顱內壓上升。4.癲癇發作。5.顱神經功能障礙。6.腦脊髓液滲漏。7.中樞神經感染與傷口感染。8.植物人或死亡。9.其他(心肌梗塞、深部靜脈栓塞、肺炎等,視病患身體健康狀況而有不同)。
在建立了正確的診斷後,則須依病理結果進行化療及放療,目前國際上有實証醫學證據的資料,可以用在惡性腦瘤化療上的藥物只有三個,一個是BCNU貼片(是在腦瘤手術後直接貼在腫瘤空腔內之貼片),一個是帝盟多口服藥,另一個是癌思停靜脈注射。這些藥物的使用已經大幅提高了惡性腦瘤的總存活率及無惡化存活復發率,但是這些藥物的使用方式及劑量則必須由專業的神經腫瘤專科醫師來執行,否則會未蒙其利而先受其害。
放射治療也是一項治療惡性腦瘤的利器,目前以使用IMRT技術的高能量射線、線性加速器來照射惡性腦瘤本身及其浸潤區為主流,立體定位放射手術(包括電腦刀及伽馬刀)則因為惡性腦瘤之界線不明顯(因為屬於浸潤性之病灶),無法明確標示出正常腦組織及惡性腦瘤組織之界線而在使用上有其限制。而已服用化學藥物之同時,再加上放射治療(即所謂的CCRT方式)已成為惡性腫瘤治療之標準。至於何時須使用CCRT或單獨使用殺死惡性腦瘤細胞之帝盟多或單獨使用抑制惡性腫瘤細胞生長之癌思停則需由專業的神經腫瘤醫師加以判斷,但不論採用何種方式,其總存活時間及疾病不復發時間皆已較10年前大幅提升,所以接受正規的治療方式對於惡性腦瘤之控制及治療都是大有幫助的。最近在台灣也開始了新的放射治療方式,比如:硼中子照射、碳十四重粒子照射、質子照射治療等等,都很積極的在進行人體試驗中,希望在不久的未來針對惡性腦瘤有更好的治療效果。
近年美國FDA通過了一項以電磁場方式讓惡性腦瘤細胞無法複製、分裂、增生而被消滅之裝置(TTF),目前也已逐步進入到臨床上使用。另外有所謂的免疫療法、基因治療也都在國內外學者的努力下逐步發展,相信在可預見的未來,惡性腦瘤的治療必將達到一個新的境界。
任何的癌症在治療上都有一個鐵律,就是「早期發現,早期治療」,在惡性腦瘤之診斷亦如是,但是困難許多,因為藉著臨床症狀及神經學檢查,要及早發現惡性腦瘤極為不易,多半需依賴影像學檢查。但在臨床實務上,包括電腦斷層及磁振攝影之檢查也不是非常方便及迅速,所以必須依賴有經驗之神經科、神經外科,甚至精神科專科醫師做專業判斷,才不會杞人憂天或耽誤病情。
腦瘤不論是良性或惡性,經手術、放射或化學藥物治療後,病患均需要定期追蹤檢查,以確定惡性腦瘤有沒有局部復發或是在腦內其他地方再復發之可能性。一般而言,病患在治療後前三個月,應至少每月門診追蹤一次,並在這三個月期間內,安排影像或必要之檢查,以確立治療的預後效果,或此期間需開始接受積極的復健治療,以免延誤康復。部分病患如需服用抗癲癇藥物,更需定期每月門診追蹤。在治療三個月後,視腦瘤的種類不同與病患神經症狀的表現,醫師會設定追蹤時間,通常在穩定情況之下可兩個月回診一次,直到一年時間,此期間醫師也會安排影像或必要之檢查。在治療期滿一年後,病患如情況穩定下,可三到四個月回診一次,每半年再安排影像或必要之檢查等。如此,在兩年後,可視病患腦瘤性質、臨床表現,把追蹤間隔延長至五到六個月,直到最少五年追蹤期為止。
影響惡性腦瘤經治療後的預後效果的因素甚多,包括惡性腦瘤的病理性質、惡性程度、生長位置、腫瘤大小、治療方法等均有關係,建議病患應與其主治醫師詳細討論請教。切莫驚慌失措,或在病急亂投醫下而耽誤了病情。
每天吃少於三餐或用餐間隔太短會縮短壽命
近年來人們試圖通過試用新的飲食方法來改善健康,例如間歇性禁食。然而,這些方法都有其缺點。美國有研究表明,每天吃三餐並且在兩餐之間保持5小時或更長的平均間隔可以降低全因死亡率和心血管疾病死亡風險。
保羅
2022 十二月 21
以前的飲食研究和目前的飲食指南主要集中在討論飲食時間、攝取量和食物模式上,近年來包括禁食天數和限時進食的間歇性禁食成為熱門的飲食方法,這種飲食模式被認為可以改善血糖控制、增強大腦功能並幫助延長壽命,但是禁食的缺點是可能導致消化問題、饑餓、疲勞和虛弱、感到焦慮及可能有缺乏營養的風險。

目前進餐頻率、跳躍式進餐和用餐間隔對健康和疾病的影響是一個普遍被關注的議題,根據2009-2010年美國國家健康和營養檢查調查(NHANES),報告進食三種標準膳食(早餐、午餐和晚餐)的成年人比例在男性中只有59%,在女性中也只有63%。男性不吃早餐、午餐和晚餐的頻率分別為19%、22%和8%,女性為19%、21%和7%。這項報告顯示了大約40%美國人是不完整的三餐進食,在20至74歲的人群中,有五分之一不吃早餐或午餐。
而進餐間隔時間,早餐和午餐之間的平均用餐間隔時間約為5小時,午餐和晚餐之間平均間隔約為6小時。與1971-1974年相比,近年來第一餐和最後一餐的間隔時間減少了約30分鐘。
問題是在《2020-2025年美國人膳食指南》沒有解決進餐頻率、跳躍式進餐和用餐間隔問題,因為膳食指南諮詢委員會沒有找到足夠的證據來總結飲食頻率與健康之間的關係。
美國孟菲斯田納西大學健康科學中心預防醫學系Yangbo Su博士及他的研究團隊進行一項前瞻性研究來探討進餐頻率、跳躍式進餐和用餐間隔與全因和心血管疾病死亡率的關係。
1999-2014年「國家健康和營養檢查研究(NHANES)」調查40歲以上成年人,收集這些人的飲食行為,分析全因死亡率和心血管疾病死亡率的關係,共收納了24,011名。
在追蹤期間內總共有4,175人死亡,其中有878人死於心血管疾病,研究人員觀察到每天吃少於三餐的受試者(佔40%)的一些共同特徵,如年輕、男性、非西班牙裔黑人、受教育程度較低、家庭收入較低、抽菸、飲酒、吃的食物不安全、吃營養較少的食物、更多零食、總體能量攝入較少。
跟每天吃三頓飯的受試者相比,每天只吃一餐會增加30%全因死亡風險和增加83%心臟病死亡風險。與吃早餐者相比,不吃早餐者罹患心臟疾病風險增加了40%,不過全因死亡率沒有差異。至於錯過午餐和晚餐者分別增加12%和16%因任何原因死亡的風險。
就用餐時間而言,與用餐間隔五小時或更長時間者相比,即使每天吃三餐但兩餐之間的平均間隔少於四個半小時,全因死亡風險增加了17%。
因此根據這個研究,建議整天最好吃到三餐,而兩餐之間的平均間隔5小時或更長可以降低全因及心臟疾病死亡風險。
停經前乳癌病患使用泰莫西芬會增加子宮疾病的風險
一項韓國新研究發現,停經前乳癌女性使用泰莫西芬(Tamoxifen)治療會增加包括子宮內膜癌在內的子宮疾病的風險。為了降低子宮內膜癌的風險,建議這些女性盡可能控制可以改變的因素,包括減肥、定期健康檢查、低脂飲食和運動。
保羅
2022 十二月 21
泰莫西芬(Tamoxifen)屬於一類稱為選擇性雌激素反應調節劑藥物(SERMs),用來治療雌激素受體陽性的乳癌,可降低高危險群乳癌復發風險。美國國立綜合癌症網路(National Comprehensive Cancer Network,NCCN)建議使用泰莫西芬5年作為雌激素受體陽性(ER+)浸潤性乳癌或導管原位癌停經前女性的輔助治療。在停經前狀態女性的輔助療法可以考慮使用泰莫西芬 5年或者更久,而停經後女性可以考慮泰莫西芬5 年或改用芳香酶抑製劑。

但是泰莫西芬也會增加包括子宮內膜癌在內的子宮疾病的風險,依據美國癌症學會資料顯示使用泰莫西芬罹患子宮內膜癌的風險約500人就有一人,風險雖然很小,但高於一般的女性。
1998年分析55項隨機試驗的統合分析發現對於罹患早期乳癌的停經後婦女使用泰莫西芬輔助治療後會增加子宮內膜癌發生率,而且死亡風險也會增加。在2018年的一項研究顯示接受泰莫西芬2至5年治療後,罹患子宮內膜癌風險增加了一倍,使用5年後增加了7倍。
雖然停經前乳癌女性病患通常使用泰莫西芬作為一線輔助治療,但是目前仍然不清楚停經前女性使用泰莫西芬是否會增加包括子宮內膜癌等的多種子宮疾病的風險?罹患子宮內膜癌的風險增加通常只限於罹患乳癌的停經後婦女,很少有文獻分析停經前婦女的子宮內膜病變。而現有指引也沒有警告使用泰莫西芬會增加潛在婦科疾病的風險,也不建議對接受泰莫西芬的停經前婦女進行子宮疾病的定期篩檢。
包括台灣在內的很多的乳癌研究顯示亞洲女性乳癌發病高峰年齡比西方女性早,台灣平均是56歲,比西方提早六年,這也可以推測亞洲女性使用泰莫西芬有更高的比例是停經前女性,因此將停經後西方女性的研究觀察結果外推到相對年輕的停經前亞洲女性是有爭議的。
最近韓國首爾高麗大學醫學院Ki-Jin Ryu博士和他同事探討使用泰莫西芬作為乳癌輔助治療是否會增加停經前韓國女性罹患子宮疾病的風險。研究人員使用韓國國民健康保險局的資料進行了一項全國性的、回顧性縱向群組研究。收納了在2003年1月至2018年12月期間診斷出乳癌的20至50歲停經前的女性,平均年齡是42.1歲,評估包括子宮內膜癌、增生、息肉和其他子宮癌等的子宮疾病的發生率。
在78,320名女性受試者中有42.2%被歸為泰莫西芬組,55.8%是對照組,平均追蹤了6.13年。結果發現新診斷的子宮內膜息肉、子宮內膜增生及子宮內膜癌發生率在每千人年中分別是20.13人、13.49人及2.01人,而其他子宮癌發病率為0.45人。在調整年齡、體重指數、糖尿病、高血壓、血脂異常、多囊卵巢綜合征、促性腺激素釋放激素激動劑治療和Trastuzumab標靶藥物治療後,泰莫西芬組的子宮內膜癌的風險是對照組的3.77倍。
總而言之,泰莫西芬組新診斷子宮內膜增生的發生率約是對照組的6.6倍、新診斷子宮內膜癌發生率是對照組的3.77倍。因此正在使用泰莫西芬停經前乳癌女性要最盡可能控制可以改變的子宮內膜癌風險因素如減肥、低脂飲食及運動等,更重要的定期接受健康檢查。
乳癌轉移在睡眠時間加速擴散
本文出自癌症新探102期
台北榮總 內科部 陳博明教授
2022 十二月 15
2017年,來自美國的三位遺傳學家傑弗理·霍爾(Jeffrey Hall)、麥可·羅斯巴希(Michael Rosbash)和麥可·揚(Michael Young)因發現控制晝夜節律的分子機制而共同贏得了諾貝爾生理醫學獎。隨後很多的學者就開始注意到癌症的治療是不是會受到晝夜不同的生理節律影響這個問題。
事實上,在2009年,來自美國北卡羅來納醫學院的 Aziz Sancar 博士領導的一個研究小組發現早上從小鼠大腦中抽取的,具有修復DNA受損能力的蛋白XPA增加,修復受損 DNA 樣本的速度比夜間抽取的快 6-7 倍。學者因此認為使用化學治療攻擊癌細胞最好在夜間癌細胞自我修復能力最低的時候,使能夠有效地提高療效,並最大幅地減少治療的副作用。

2014年以色列魏茨曼科學研究所的研究人員發現,一些小鼠的癌症可能在夜間、休息時間比白天生長得更快。 研究人員使用EGFR(表皮生長因子受體)為生物標記,正常細胞表面的EGFR能刺激細胞生長和分裂,然而在許多癌細胞表面也有這種受體,而且呈現高度表達或突變,能夠加速刺激癌細胞的生長和擴散,目前可以使用抗EGFR的標靶藥物來治療它。
研究人員在使用小鼠的實驗中發現癌細胞表面EGFR的高度表現在夜間更加明顯,而在白天則較不活躍。因此他們在晝夜的不同時間給帶有EGFR高度表現腫瘤的小鼠一種抗EGFR標靶藥物,結果發現治療後腫瘤大小存在顯著差異,在睡眠時間接受治療的小鼠比在清醒時間接受治療的小鼠顯示出腫瘤變小很多。
那麼在人類的癌症是否也有相同的現象呢?睡眠時間接受治療也會比清醒時更有效嗎 ?
2021年美國埃默里大學 Winship 癌症研究所Qian 等人大膽地喚醒了臨床癌症「時間免疫治療」領域。146名第四期惡性黑色素瘤病患接受「免疫檢查點抑制劑 (ICI)」,治療的時間是在下午2點到晚上8點之間。以下午4點30分為分隔點,73名病患至少有20%的「免疫檢查點抑制劑」輸注時間在下午4點30分以後,另外73名病患在4點30分以前完成大於80% 的抑制劑輸注。 研究結果發現,下午4點30分以前給藥的群組幾乎使整體存活期增加了一倍。同時也發現在下午4:30之後接受至少輸注20%「免疫檢查點抑制劑」的病患,全因死亡風險增加了31%,這種增加在女性、腦轉移患者,和接受雙重免疫「免疫檢查點抑制劑」治療的病患更為明顯。
同年,英國考文垂華威大學的醫學腫瘤學家Francis Levi博士的研究報告分析了95名第四期的非小細胞肺癌病患,分成在下午12:54之前或之後輸注「免疫檢查點抑制劑」nivolumab兩組。臨床試驗資料顯示,早上輸注者的早期疾病惡化風險降低了四倍,並降低了早期死亡的風險;又,進一步的分析結果也顯示nivolumab 給藥的時間是疾病無惡化存活期和整體生存期的獨立預後因素。
雖然生物時鐘對人體免疫反應的影響已經眾所周知,但是免疫治療輸注時間真的是上午比較好嗎?人體和小鼠的時間治療反應還是不一樣嗎?
在這裡要提醒的是,上述的人體臨床試驗都沒有包括在睡眠時間給予癌症治療的成果!
最近瑞士聯邦理工學院Diamantopoulou及Aceto教授所帶領的研究團隊,使用「循環腫瘤細胞」(CTC)為檢測工具進行一項探討乳腺癌病患和小鼠模型血液中形成的轉移性「循環腫瘤細胞」與晝夜節律關係的研究給了我們答案。
他們推論乳腺癌轉移在睡眠期間加速擴散,可能是最好的治療時機!癌症轉移性擴散是不斷從生長的腫瘤細胞中脫落,經由血管傳播到全身,脫落下來的細胞被稱為「循環腫瘤細胞」,然而它們生成的時間動態和腫瘤細胞轉移的過程、以及晝夜節律如何影響腫瘤發生等,目前仍然不清楚。
研究人員收納了30名乳腺癌女性病患,分別在凌晨4點和上午10點採集了血液標本,這兩個時間分別代表身體休息時間(靜止期)和活動時間(活動期),同時在小鼠模型中也進行類似的實驗。
結果發現超過78.3%的循環腫瘤細胞是在靜止期採集到的,但是在白天很少,在小鼠實驗上也有類似的情形:另外,將兩種類型的「循環腫瘤細胞」注射到無腫瘤小鼠體內,小鼠睡眠時肺臟內積累脫落的「循環腫瘤細胞」水平高於清醒時脫落的「循環腫瘤細胞」水平,小鼠體內87〜99.2%的循環腫瘤細胞是在睡眠期間產生;又,在休息期間將「循環腫瘤細胞」注射到小鼠體內時也有更高轉移的傾向。
從小鼠身上更發現夜晚產生的「循環腫瘤細胞」分裂比白天產生得更快,因此具有更高的轉移潛力,而白天產生的「循環腫瘤細胞」缺乏轉移能力。這是受到什麼因素影響呢?主要是因為晝夜節律的關係,「循環腫瘤細胞」從原始腫瘤中脫落、逃逸是受到如褪黑激素、睾酮和糖皮質激素等晝夜節律的激素所調控,這些激素會影響「循環腫瘤細胞」的生成和增殖。
因此當乳腺癌病患在睡眠時,腫瘤會產生更多的循環細胞;與白天脫落腫瘤的「循環腫瘤細胞」相比,夜間脫落的「循環腫瘤細胞」分裂更多、更快,轉移性更高。
這一項刊載在學術界頂尖的《自然》雜誌上的重要發現,可能改變了我們的癌症治療思維,以後對癌症病患的檢查時間跟治療方式是不是要將晝夜節律納入考慮?例如抽血時間是不是不在白天清晨七八點,而是改在夜間的休息時間?有些文獻也認為免疫治療時間在夜間休息時比白天療效更好,與這項研究結論相符。當然這些都需要更大型的試驗才能證明是不是有再現性,以及是否適用於其他癌症。
癌症會自然消失嗎?
未經治療的癌症不會自然消失,病患不應該期望癌症在沒有治療的情況下自然完全消退,應該接受正規的治療。
保羅
2022 十二月 15
有一些癌症病患認為癌症可能會在沒有接受治療的情況下自然消失。根據美國臨床腫瘤學會(ASCO)最近的一項調查顯示有40%的美國人認為不需要接受正規醫療,僅靠替代療法就可以完全治癒癌症。
例如蘋果創辦人賈伯斯在2003年罹患胰臟神經內分泌腫瘤,這種腫瘤預後比胰臟腺癌好,五年存活率可以達到60%,如果能夠立刻手術切除腫瘤,有些病患甚至可以治癒或存活超過十年。但是賈伯斯卻對主流醫學始終抱持懷疑的態度,拒絕手術治療,嘗試以嚴格素食、服用草藥、清洗大腸祛毒療法及一些另類療法等來增加免疫能力對抗癌症,但是9個月後,胰臟腫瘤持續長大後並且轉移到肝臟,接受手術已經為時已晚。

晚期實體瘤自然消退雖然有可能發生但是非常少見,只有約十萬分之一,不過這個比例可能被低估了。過去一些文獻顯示即使沒有接受治療,無論是自發性或是安慰劑效應,實體瘤也可能消退。在2003年的一項統合分析發現在隨機對照試驗中,隨機接受安慰劑或最佳支援性治療的晚期實體瘤病患的整體反應率為2%。這一項發現在2016年的另一項研究中也得到證實。
那晚期實體瘤自然消退發生機率是多少?加拿大金士頓皇后大學首席研究員Bishal Gyawali博士和他的同事最近發表的研究是從另外一個角度來推測晚期實體瘤自發消退的機率。
研究分析了2015至2021年間發表的45項隨機對照試驗中的安慰劑整體反應率,其中治療組是將癌症藥物用於治療晚期實體瘤,而納入安慰組中的5684名患者使用的安慰劑是惰性物質,本身沒有任何抗腫瘤作用。
自然消退機率可以通過隨機試驗中的安慰組反應率推斷出來。這些病患最常見的癌症類型是肝細胞癌(20%),有80%接受標靶治療。只有6項試驗(12%)是在初次接受治療的臨床試驗,其餘的是在二線或後續治療。
結果顯示在安慰組中可評估整體反應率的4760名病患中隨機效應模型的整體反應率是1%。而在可以評估部分或完全緩解的3808名病患者中隨機效應模型的完全緩解率為0%,部分緩解率為1%。研究發現安慰劑的整體反應率與之前兩項研究相似,都在1%〜 2%之間。
各個試驗的安慰劑整體反應率存在很大的差異,因此此研究也根據腫瘤類型進行了亞組分析。結果發現不同腫瘤類型接受安慰劑反應率存在明顯差異,攝護腺癌是7%,肉瘤是4%,肝細胞癌是2%,胃食道是為1%,結直腸癌、肺癌和其他腫瘤類型都是0%。
總而言之,雖然在沒有接受治療狀況下,有1%的晚期實體瘤病患也可以期望獲得一些反應,但是未經治療的腫瘤完全消退非常罕見,幾乎為零,因此病患不應該期望癌症在沒有治療的情況下自然完全消退,希望這一項研究能夠說服病患不要放棄癌症治療。
文章分類
- 抗癌新知 [1990]
- 胃癌 [92]
- 衛教專欄 [804]
- 其他 [1007]
- 乳癌 [672]
- 胰臟癌 [60]
- 淋巴瘤 [131]
- 肺癌 [276]
- 健康新知 [112]
- 肝癌 [165]
- 新藥專欄 [103]
- 食道癌 [40]
- 大腸癌 [317]
- 頭頸癌 [66]
- 腦瘤 [15]
- 卵巢癌 [46]
- 子宮頸癌 [59]
- 口腔癌 [36]
- 白血病 [101]
- 腎臟癌 [50]
- 膀胱癌 [25]
- 攝護腺癌 [90]
- 黑色素瘤 [2]
- 骨髓瘤 [18]
- 甲狀腺癌 [2]
- 認識癌症 [11]
- 症狀 [14]
- 醫療文獻 [141]
- 衛教手冊 [14]
- 免疫治療 [3]
- 病友園地 [89]
- 甲狀腺癌 [12]
- 鼻咽癌 [14]
- 皮膚癌 [19]
- 書摘專欄 [51]
- 人物介紹 [32]
- 乳癌治療 [1]
- 成因 [35]
- 名家專欄 [18]
- 幹細胞移植 [41]
- 即時新聞 [4]
- 疑問醫答 [732]
- 肺癌新聞 [0]
- 醫師手札 [1]
- 其他 [7]
- 喉癌 [4]
- slide [10]
- 放射治療 [11]
- 化學治療 [39]
- 標靶治療 [30]
- 預防 [14]
- 其他治療 [18]
- 預後 [13]
- 專題報導 [276]
- 診斷 [14]
- 支持與緩和醫療 [9]
- 病理 [6]
- 護理專欄 [88]
- 營養圈 [5]
- 外科手術 [11]
- 分期 [3]
- 荷爾蒙治療 [9]
- 預後 [0]
- 病理 [2]
- 肉瘤 [23]
- 護士札記 [9]
- 臨床試驗 [6]
- 醫學逸趣 [3]
- 生殖細胞癌 [5]
- 膀胱癌 [17]
